Katarzyna Pinkosz, Wprost: Osoby leczone radioterapią rzadko zastanawiają się, gdzie wytwarzane są urządzenia, za pomocą których są leczone: akceleratory. Jak działają akceleratory medyczne?
Prof. dr hab. inż. Sławomir Wronka: Akceleratory to urządzenia do przyspieszania cząstek naładowanych: elektrony, protony oraz atomy, które nie są elektrycznie obojętne, możemy przyspieszać w polu elektrycznym i wykorzystywać do różnych zastosowań, np. w medycynie do leczenia pacjentów; w przemyśle do modyfikacji materiałów; przy ochronie granic do sprawdzania, co jest znajduje się w ciężarówkach wjeżdżających na teren Polski. W uproszczeniu można powiedzieć, że akcelerator to elektryczne urządzenie, które służy do uzyskania promieniowania jonizującego.
W medycynie wiązka promieniowania jest wykorzystywana przede wszystkim do radioterapii, w celu zniszczenia komórek nowotworowych, przy maksymalnym oszczędzaniu komórek zdrowych.
Pacjenci często obawiają się radioterapii z powodu możliwych skutków ubocznych…
Prof. Sławomir Wronka: Radioterapia to jedna z trzech podstawowych metod leczenia nowotworów, obok chirurgii i chemioterapii. Jest stosowana miejscowo, do niszczenia komórek nowotworowych w konkretnym obszarze. To promieniowanie jest zabójcze, jednak fizycy medyczni, lekarze onkolodzy robią wszystko tak, by to zabójcze działanie promieniowania niszczyło komórki nowotworowe, oszczędzając zdrowe. Dostosowujemy dawkę do tolerancji komórek zdrowych. Oczywiście, mogą zdarzyć się powikłania, ale nie są one zabójcze. Chcemy pacjenta wyleczyć – kosztem akceptowalnych skutków ubocznych.
Dziś radioterapia jest zupełnie inna niż 20-30 lat temu, między innymi dzięki nowoczesnym urządzeniom, które powstają także tu – w Narodowym Centrum Badań Jądrowych. Jakie akceleratory tu są tworzone?
Prof. Sławomir Wronka: Rozwój akceleratorów w dużej mierze polegał na zwiększaniu energii wiązki. Większa energia przyspieszanych cząstek powoduje, że dawka jest deponowana głównie w głębi ciała, a nie na skórze. Zwykła lampa rentgenowska, wynaleziona ponad 100 lat temu, również mogłaby być wykorzystywana do leczenia nowotworów, ale tylko powierzchniowych, na skórze. Jeśli chcielibyśmy lampą rentgenowską leczyć tkanki głębiej położone, wiązałoby się to ze zniszczeniem skóry.
Akceleratory zapobiegają temu poprzez wykorzystanie wiązek o dużo większych energiach. Oczywiście w ciągu ostatnich dwudziestu lat znacząco rozwinęły się układy sterowania i kontroli, sposoby weryfikacji obszaru leczonego za pomocą obrazowania, specjalne kolimatory i wiele innych technik i metod, których wszystkich nie sposób wymienić.
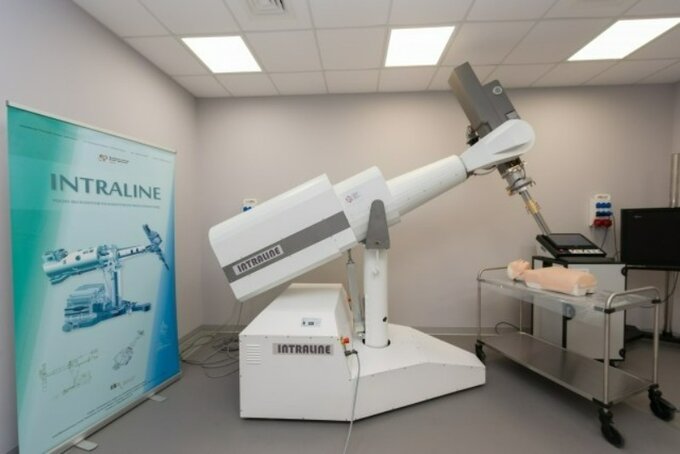
W NCBJ stworzyliście m.in. akcelerator śródoperacyjny. Na czym polega jego działanie?
Dyrektor Jan Trzuskowski: Akcelerator do terapii śródoperacyjnej służy do naświetlania komórek nowotworowych, które pozostały po usunięciu chirurgicznym guza. Takie urządzenie podjeżdża do pacjenta, który leży na stole operacyjnym, wkładamy w lożę operacyjną aplikator, który prowadzi wiązkę elektronów niszczących komórki nowotworowe, jakie mogły pozostać po usunięciu guza.
Akcelerator, który stworzyliśmy, przekazaliśmy do Wielkopolskiego Centrum Onkologii w Poznaniu, z którym współpracowaliśmy, w celu oceny klinicznej. Po uzyskaniu pozytywnej oceny klinicznej, urządzenie zostanie przekazane do leczenia.
Takie urządzenie to ogromna praca inżynierów, naukowców, lekarzy. Ile lat trwa, zanim zostanie stworzone?
Jan Trzuskowski: Kilka lat, a czas pandemii, powodujący wiele ograniczeń, jeszcze ten okres wydłużył. Podczas tworzenia tego akceleratora współpracowaliśmy z lekarzami, fizykami, z operatorami z WCO, przystosowaliśmy je do potrzeb użytkowników.
To nie jest jednak jedyny akcelerator, który tu w NCBJ udało się stworzyć?
Prof. Sławomir Wronka: Jeśli chodzi o medycynę, to akcelerator śródoperacyjny jest naszym głównym projektem. Jego kontynuacją i uzupełnieniem jest akcelerator do terapii bardzo wysokimi mocami dawek.
Dla naukowców to była lekcja pokory: przez wiele lat wydawało się, że już bardzo dobrze rozumiemy leczenie onkologiczne, wiemy, jak komórki reagują na promieniowanie, w jakich porcjach (frakcjach) to promieniowanie należy dostarczać. Pacjent przychodził codziennie przez kilka tygodni na napromienianie w małych dawkach tak, by nie uszkodzić komórek zdrowych. Wiemy, że komórki nowotworowe są naprawiane dużo gorzej, dużo mniej efektywnie niż komórki zdrowe. Dlatego dajemy zdrowym komórkom czas na naprawę. Komórki nowotworowe łatwiej ulegają uszkodzeniu i naprawiają się gorzej. Mieliśmy już opanowany sposób postępowania dla danego nowotworu, a tu nagle okazało się, że jeśli tę sama dawkę dostarczymy nie w ciągu kilku minut, tylko w ułamek sekundy, to odpowiedź organizmu jest zupełnie inna.
Silniejsza?
Prof. Sławomir Wronka: Komórki zdrowe reagują dużo słabiej, czyli łatwiej je oszczędzić, natomiast dużo szybciej ulegają zniszczeniu komórki nowotworowe. Ten efekt wysokiej dawki szybko podanej, był zaskakujący. Co więcej, dobrze nie wiemy, dlaczego tak się dzieje. Możemy jednak ten efekt wykorzystywać, dlatego nasz następny akcelerator dostarcza bardzo dużej mocy dawek w krótkim czasie, żeby efektywniej prowadzić leczenie. A my mamy lekcję pokory, ponieważ myśleliśmy, że już wszystko wiemy; tymczasem okazało się że nie, że natura odkrywa przed nami nieznane obszary.
Duża dawka promieniowania jest w stanie szybko zniszczyć komórki nowotworowe, ale pozostawić komórki zdrowe. Ta sama dawka, która zniszczyłaby komórki zdrowe, dostarczona w krótkim błysku nie niszczy zdrowych komórek. Dlaczego: tego nie wiemy.
Stworzenie tego nowego urządzenia to były też lata pracy?
Jan Trzuskowski: Niecałe dwa lata. To urządzenie też jest już przekazane do Wielkopolskiego Centrum Onkologii. Korzystają z niego radiobiolodzy, którzy zajmują się badaniem zjawiska wpływu promieniowania na różnego rodzaju komórki. Okazało się, że na komórki różnych nowotworów promieniowanie działa w różny sposób. Dostarczyliśmy urządzenie, które ma możliwość modyfikowania wiązki, badania wpływu tych parametrów na zachowanie się komórek, zarówno zdrowych, jak nowotworowych.
A jak wygląda bezpieczeństwo pacjenta? Czy przy stosowaniu dużych dawek nie ma większego ryzyka napromienienia zdrowych tkanek, np. jeśli pacjent poruszy się mimowolnie?
Prof. Sławomir Wronka: O bezpieczeństwie pacjenta myślimy przede wszystkim i to jest to, czym różni się zwykły akcelerator od akceleratora medycznego. Jest cały system zabezpieczeń, by nie narazić na promieniowanie operatora, który cały czas jest przy terapii, ani pacjenta na niepotrzebną, rozproszoną dawkę. Każdy element akceleratora jest zabezpieczony podwójnie, a często potrójnie. Gdy jedziemy samochodem i coś by się zepsuło, np. urwałaby się kierownica, to mielibyśmy problem. W akceleratorze żadne pojedyncze uszkodzenie nie może doprowadzić do zagrożenia dla pacjenta.
Oczywiście, pacjent nie poruszy się, ponieważ cały zespół pilnuje, żeby unieruchomienie było takie, by nie zaszkodzić pacjentowi np. w przypadku zakasłania. Akcelerator też nie ma prawa wykonać żadnego zbędnego ruchu. Moc dawki jest bardzo precyzyjnie określona i pilnowana, by oszczędzić zdrowe komórki.
A poruszanie się klatki piersiowej przy oddychaniu nie wpłynie na to, że zostanie napromieniony nie ten obszar, który powinien? Np. w przypadku raka płuca?
Prof. Sławomir Wronka: Nowoczesna technologia umożliwia kilka rozwiązań tego problemu. Pierwsza rzecz to współpraca z pacjentem, jeśli jest on w stanie wstrzymać oddech lub w pewnym zakresie go kontrolować. Druga: śledzimy ruchy oddechowe pacjenta i włączamy/ wyłączamy wiązkę, gdy obszar naświetlania wyjdzie poza zdefiniowany przez nas cel. Trzecia opcja: urządzenie podąża za ruchem oddechowym pacjenta. Zakłada on np. koszulkę w paski; wtedy łatwiej śledzimy jego ruchy oddechowe. Wszystkie te rozwiązania istnieją na rynku. W przypadku naszego akceleratora nie ma takiej konieczności, gdyż pacjent jest uśpiony. Nasz akcelerator jest przeznaczony do wykorzystania przy operacjach oszczędzających, np. nowotworów piersi, układu pokarmowego. W przypadku płuc to urządzenie nie było jeszcze testowane, ale kto wie, co przyniesie przyszłość.
Czym pod względem technicznym różni się akcelerator śródoperacyjny od tego, którym są napromieniani pacjenci w normalnych cyklach radioterapii?
Jan Trzuskowski: Jest to akcelerator mobilny, podjeżdża pod łóżko pacjenta. Jeśli chodzi o promieniowanie, to emituje tylko wiązkę elektronów, ponieważ nie są one tak przenikliwe jak promieniowanie fotonowe; działają bezpośrednio na komórki, które są w polu wiązki. Kolejny element to sterylny aplikator, biokompatybilny, ograniczający promieniowanie rozproszone.
Ten aplikator to patent NCBJ, opracowaliśmy go podczas tworzenia akceleratora. Ten aplikator jest przezroczysty, umożliwia osłonę tych części ciała, które nie powinny być naświetlane.
Akcelerator trafił do WCO. Czy trafi też do innych ośrodków onkologicznych, gdzie jest stosowana radioterapia i wykonywane są operacje?
Jan Trzuskowski: Liczymy, że tak się stanie.
Co dalej? Jakie kolejne plany?
Jan Trzuskowski: Na tym etapie będziemy udoskonalać stworzony przez nas akcelerator, są możliwości rozbudowy, bardziej ekonomicznego wykorzystania. Odeszliśmy od produkowania tradycyjnych akceleratorów, są producenci, którzy tym się zajmują. My jesteśmy instytutem naukowym, badawczym, chcemy tworzyć nowe innowacyjne rozwiązania, nowe urządzenia.
Jako fizyk: jak widzi Pan przyszłość akceleratorów w medycynie?
Prof. Sławomir Wronka: Efekt flash, czyli błysku, łatwo jest uzyskać dla wiązek bezpośrednich, jak elektrony czy protony. Natomiast fotony uzyskujemy pośrednio, przez uderzenie elektronem w tarczę konwersji. Wydajność tego procesu jest dosyć niska, dlatego uzyskanie efektu flash, czyli bardzo wysokiej mocy dawki, dla fotonów obecnie jest wyzwaniem inżynieryjnym, konstrukcyjnym. Powinna być to nowa generacja maszyn, znacznie wydajniejszych.
Jeśli będziemy mieli bardziej wydajną wiązkę i zastosowalibyśmy tradycyjną tarczę konwersji, to uległaby ona stopieniu. Dlatego trzeba zaprojektować nową tarczę dla fotonów. Z kolei tak wysokie dawki muszą być mierzone w nowy sposób. Detektory dotychczas używane wymagają modyfikacji.
Kolejna rzecz to terapia przestrzenna, okazuje się, że jeśli to samo zjawisko błysku zastosujemy przestrzennie, czyli zamiast szerokiej wiązki podzielimy ją na takie mikroszpileczki, to odpowiedź organizmu będzie jeszcze inna. Naświetlamy ten obszar malutkimi, ale bardzo wysokimi mocami dawek, pomiędzy nimi pozostawiając obszary nienaświetlone.
Okazuje się, że jest „zjawisko świadka”: komórki nienaświetlone też ulegają zniszczeniu, ponieważ sąsiadują z komórkami zniszczonymi. Naświetlanie takimi „szpilkami” powoduje zupełnie inną odpowiedź organizmu. W powiązaniu z wysokimi mocami dawek to zupełnie nowe pole: do zbadania i zastosowania.
A korzyści dla pacjentów?
Prof. Sławomir Wronka: Wszystko to robimy dla pacjentów, żeby leczyć, przedłużyć życie, poprawiać jego jakość, jak najmniejszym kosztem skutków ubocznych.
Jan Trzuskowski: Terapia flash, jeśli okaże się skuteczna, spowoduje, że pacjent w ciągu jednej sesji dostanie wystraczającą dawkę, podczas gdy obecnie musi zgłaszać się do szpitala wiele razy. Nie będzie musiał wracać do traumy szpitalnej. Będzie to miało ogromny wpływ na jego psychikę. Takie leczenie będzie też bezpieczniejsze dla pacjentów.
Radioterapia jest dziedziną medycyny, która będzie się rozwijać?
Prof. Sławomir Wronka: Radioterapia jest niezwykle fascynującą dziedziną medycyny. Bardzo ważna jest tu współpraca lekarzy, fizyków, elektroników, elektryków, programistów – by uczynić z radioterapii narzędzie przyszłości. To jeden z najbardziej dynamicznie rozwijających się obecnie działów medycyny.
Prof. dr hab. inż. Sławomir Wronka jest kierownikiem Zakładu Fizyki i Techniki Akceleracji Cząstek NCBJ. Jan Trzuskowski jest dyrektorem ds. Technicznych Zakładu Aparatury Jądrowej ZdAJ NCBJ.
Polska nauka
dla rozwoju medycyny i zdrowia Polaków
Przeczytaj inne artykuły poświęcone polskiej nauce
Projekt finansowany ze środków budżetu państwa, przyznanych przez Ministra Nauki w ramach Programu Społeczna Odpowiedzialność Nauki

